技術・ソリューション
医薬品GMP・バリデーション
GMPとは、Good Manufacturing Practiceの略称で、一般的に品質の良い優れた製品を製造するための要件をまとめたものを指します。特に医薬品の製造を行う者が守るべき要件を定めた「医薬品の製造管理及び品質管理に関する基準」を指す場合は、医薬品GMP、または単にGMPと呼びます。
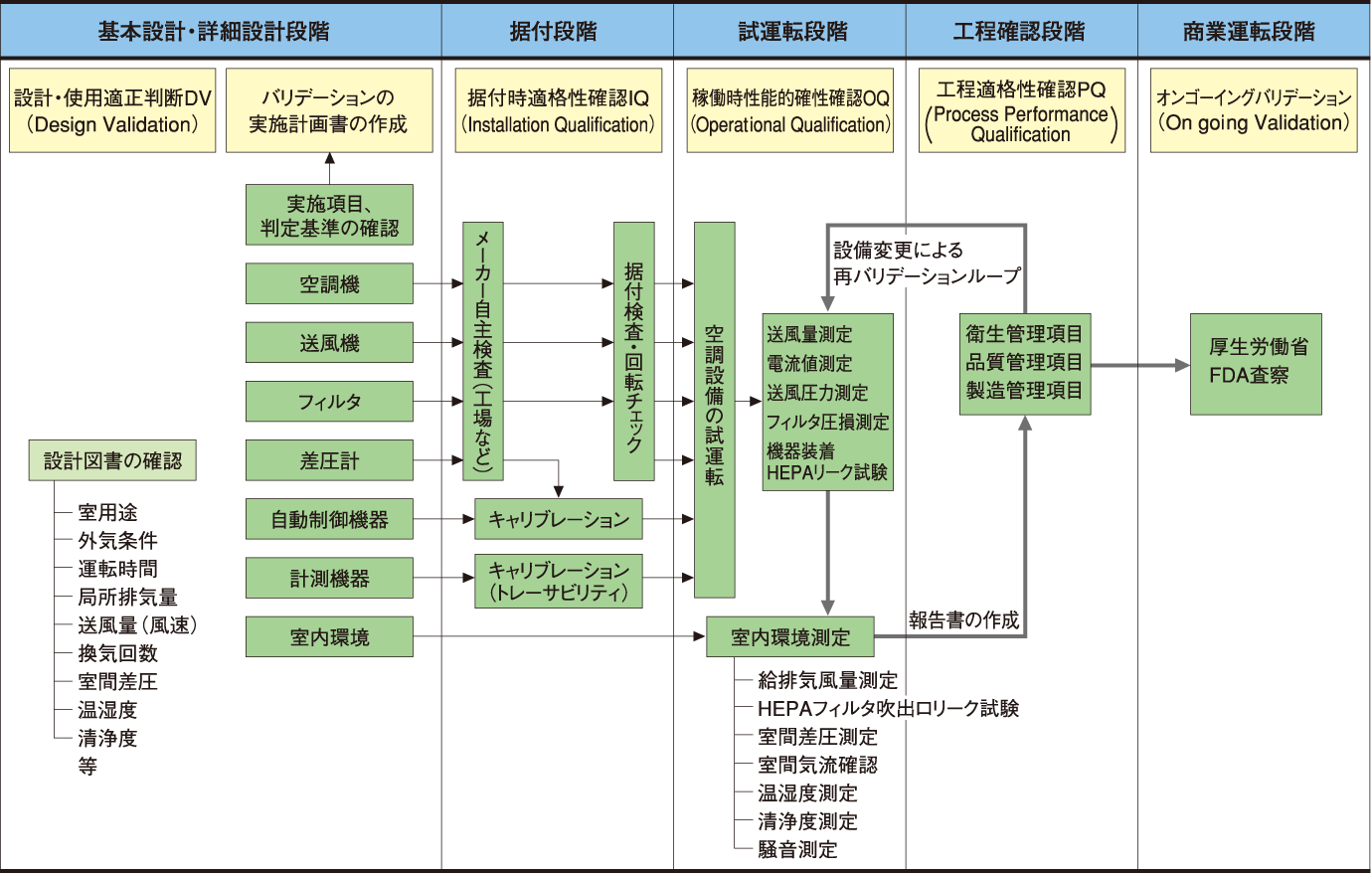
GMPにおけるバリデーションとは、製造設備や製造工程・方法が目的とする品質に適合する医薬品を恒常的に製造できることを科学的に検証することです。医薬品製造を支援するシステムとして、空調処理システムは製造用水供給システムとともにバリデーションの対象となっています。
空調処理システムにおけるバリデーション 実施例
無菌医薬品製造における清浄区域の区分
| 厚生労働省 無菌繰作法による無菌医薬品の製造に関する指針(2011) | ||||||
|---|---|---|---|---|---|---|
| 名称 | 空気の清浄度レベル※1 | 最大許容微粒子数(個/m3) | ||||
| 非作業時 | 作業時 | |||||
| ≧0.5μm | ≧5.0μm | ≧0.5μm | ≧0.5μm | |||
| 無菌操作区域 | 重要区域 | グレードA(ISO5) | 3,520 | 20 | 3,520 | 20 |
| 直接支援区域 | グレードB(ISO7) | 3,520 | 29 | 352,000 | 2,900 | |
| その他の支援区域 | グレードC(ISO8) | 352,000 | 2.9 | 3,520,000 | 29,000 | |
| グレードD | 3,520,000 | 29,000 | 作業形態による※2 | 作業形態による※2 | ||
※1:括弧内のISOクラスは、作業時の微粒子数に対応したものである。 ※2:最大許容微粒子数を規定しないケースもある。
| PIC/S GMPガイドAnnex1(2009) | ||||
|---|---|---|---|---|
| グレード | 表示サイズ以上のm3 当たりの最大許容微粒子数 | |||
| at rest (非作業時) | in operation(作業時) | |||
| 0.5μm | 5.0μm | 0.5μm | 5.0μm | |
| A | 3,520 | 20 | 3,520 | 20 |
| B | 3,520 | 29 | 352,000 | 2,900 |
| C | 352,000 | 2.9 | 3,520,000 | 29,000 |
| D | 3,520,000 | 29,000 | 定義なし | 定義なし |
| FDA 無菌製剤ガイダンス(2004) | ||
|---|---|---|
| クリーンエリアの分類 | ISO | ≧0.5μmの粒子数/m3 |
| (0.5/μm粒子数/ft3) | ||
| 100 | 5 | 3,52 |
| 1,000 | 6 | 35,200 |
| 10,000 | 7 | 352,000 |
| 100,000 | 8 | 3,520,000 |
FDAの無菌ガイダンスの区分は、作業時におけるものである。
